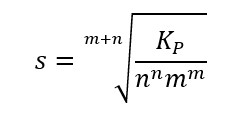In una reazione tra 2 fasi diverse le molecole tengono a creare un equilibrio detto equilibrio di solubilità. Scriviamo una reazione chimica in cui un elettrolita forte (α = 1) solido AB si dissocia in due ioni liquidi: A e B
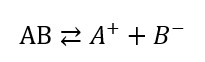
Definiamo s la solubilità di questa reazione e calcoliamo la costante di equilibrio:
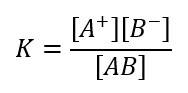
Definiamo il prodotto di solubilità (indicato con Kp ):
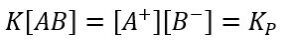
In una soluzione sempre di dissociamento di un solido in due ioni liquidi del tipo:
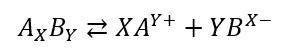
Con costante di equilibrio uguale a:
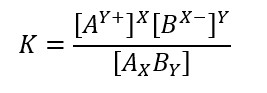
La solubilità (indicata con s) è scritta in moli su litro, quindi può essere correlata alla concentrazione tramite queste due formule:
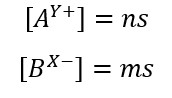
Mettendo queste due formule nell’equazione del prodotto di solubilità otteniamo:
![]()
Da cui ricaviamo la solubilità della soluzione: