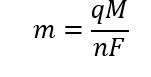Le leggi di Farady sono i fondamenti delle reazioni redox delle celle galvaniche ed elettrolitiche e sono le seguenti:
- “Le masse delle sostanze ossidate o ridotte agli elettrodi sono direttamente proporzionali alla quantità di elettricità che attraversa la cella”
Cioè:
![]()
In cui m è la massa in grammi della sostanza ossidata o ridotta, q è la carica e è l’equivalente elettrochimico, cioè la massa in grammi di sostanza ossidata o ridotta al passaggio di un Coulomb di carica.
- “Al passaggio della stessa quantità di elettricità, al catodo e all’anodo si riducono e si ossidano masse proporzionali ai pesi equivalenti delle specie coinvolte”
Scritto in formule abbiamo che:
![]()
Sostituendo i pesi equivalenti con le masse molari (M) diviso il numero di elettroni (n) e usando le formule inverse ricaviamo: