La soluzione consiste nel rompere i legami che costituiscono le molecole del soluto in un solvente polare che, con la sua forza di attrazione, è in grado di attrarre gli atomi che costituiscono le molecole del soluto creando due ioni, l’anione è l’atomo più elettronegativo mentre il catione è l’atomo meno elettronegativo (per esempio il sale disciolto nell’acqua da origine all’anione Cl- e il catione Na+). Le soluzioni possono avvenire anche tra sostanze simili.
Il soluto viene detto elettrolita, ed è un elettrolita forte se da alla soluzione un’alta conducibilità elettrica, mentre è un elettrolita debole se la soluzione è isolante (per poter creare una corrente occorre molta più energia rispetto a un semiconduttore o un conduttore).
La qualità di un elettrolita si calcola tramite la costante di dissociazione αα, tramite la seguente formula:
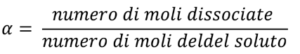
in cui il numero di moli dissociate è il numero di moli di soluto che si sono completamente distaccati tra di loro formando ioni.
Una soluzione è detta satura se la quantità di soluto che si può sciogliere a contatto con il solvente ad una determinata temperatura pressione è massima.
