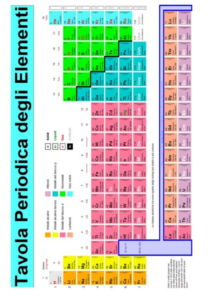
La tavola periodica rappresenta tutti gli atomi presenti nella Terra (92 naturali e 26 artificiali) e vengono distinti tra di loro per il numero atomico.
La tavola periodica degli elementi è suddivisa in 7 linee orizzontali dette periodi.
Gli elementi sono suddivisi in:
- Metalli alcalini terrosi e metalli alcalini che appartengono al blocco s, cioè il loro orbitale di valenza è un orbitale di tipo s.
- Gas nobili (tranne l’elio), metalli di post-transizione, i nonmetalli reattivi e i semimetalli (hanno proprietà intermedie tra liquidi e solidi) che appartengono al blocco p perché il loro orbitale di valenza è di tipo p.
- Metalli di transizione che appartengono al blocco d perché il loro orbitale di valenza è un orbitale di tipo d.
- Attinidi e Lantanidi (cioè gli elementi artificiali) appartengono al blocco f perché il loro orbitale di valenza è uno di tipo f.
Inoltre si distinguono per le loro caratteristiche a pressione di un atmosfera e a temperatura ambiente:
- I metalli di transizione hanno lucentezza, malleabilità, durezza, alta resistenza e possono essere semi-conduttori o conduttori e sono solidi.
- I metalli di post-transizione hanno punti di fusione e di ebollizione più bassi di quelli dei metalli di transizione, hanno minor resistenza dei metalli di transizione e sono solidi.
- I nonmetalli reattivi tendono a reagire con altre molecole o atomi con poca energia di attivazione (vedi capitolo sulla Termodinamica), mentre i gas nobili hanno bisogno di molta energia per reagire e sono gassosi.
- I semimetalli hanno proprietà intermedie tra liquidi e solidi.
- I metalli alcalini reagiscono con poca energia, hanno una bassa energia di ionizzazione e bassa elettronegatività.
- I metalli alcalino-terrosi sono facilmente ossidabili, poco densi, duttili e malleabili.
- I lantanidi sono elementi artificiali duttili e malleabili.
- I attinidi sono elementi artificiali che reagiscono con poca energia.