![]()
In questo tipo di reazione chimica la costante di equilibrio risulta uguale a:
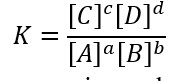
E la formula per l'energia libera è la seguente:
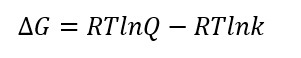
DIMOSTRAZIONE DELLA FORMULA
L’energia libera di una reazione sappiamo che è:
![]()
Sapendo che H = PV + E e, trasformando il tutto in termini differenziali, otteniamo:
![]()
Sapendo che dE = dQ – dL dL = pdV e che TdS = dQ otteniamo:
![]()
Ponendo la temperatura costante (dT = 0) e usando l’equazione dei gas ideali, abbiamo che:
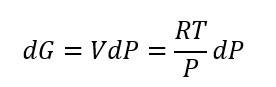
Integriamo ambo i membri G tra G e G0 e P tra P e P0 si ottiene:
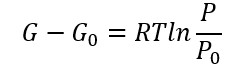
Quindi, spostando G0 da destra sinistra, si ottiene:
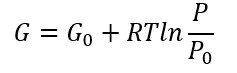
Moltiplico per il numero di moli:
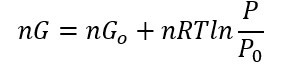
Sapendo che:
![]()
Si ottiene:
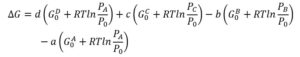
(attenzione che le lettere minuscole all’apice delle G non sono esponenziali) ponendo la somma di tutte le G0 e ![]() usando le proprietà dei logaritmi otteniamo:
usando le proprietà dei logaritmi otteniamo:
All’equilibrio G = 0 e sapendo che:
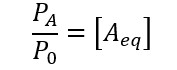
(In qui equivalente scritto in basso indica che ci si sta riferendo alla concentrazione parziale di A)
Otteniamo questa importante equazione:
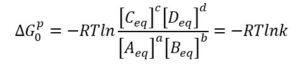
E quindi:
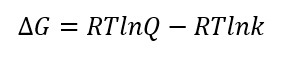
In cui Q è il quoziente di reazione.
