L’energia elettrica attraverso i fluidi avviene tramite reazioni redox di ossido-riduzione tra un catodo (metallo in cui avviene la riduzione) che è il polo positivo e un anodo(in cui avviene l’ossidazione)che è il polo negativo, può avvenire in due modi:
- Nell’elettrolisi (su cui si basa il funzionamento delle pile) l’energia elettrica viene trasformata in energia chimica, cioè il movimento degli elettroni dall’anodo al catodo avviene in maniera forzata dalla corrente ( che ha lo stesso verso del movimento degli elettroni) generata da un generatore di tensione.
Immagine di una cella elettrolitica a basa di una reazione redox tra cloro e sodio:
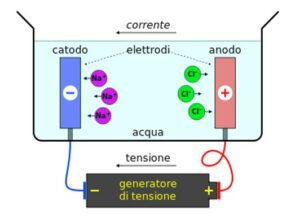
- Nelle celle galvaniche l’energia chimica viene trasformata in energia elettrica. Nelle celle galvaniche il catodo e l’anodo sono collegati da un ponte salino da cui passano gli elettroni insiem al liquido in maniera spontanea (per l’osmosi) .
Immagine di una cella galvanica:
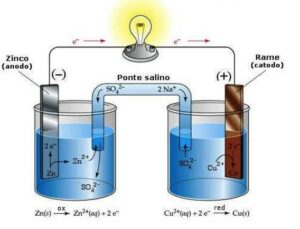
Una reazione redox tipica nelle celle galvaniche ed elettrolitiche è quella tra rame e zinco:
![]()
Come si può intuire dalla reazione lo zinco è l’anodo (perché si riduce) mentre il rame è il catodo (perché si ossida).
