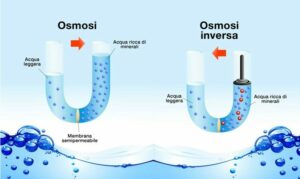
La 2° proprietà colligativa è l'osmosi, cioè quando il soluto e il solvente sono separati da una superfice semipermeabile all’interno di un tubo a U. Si chiama pressione osmotica la pressione esercitata dal peso del solvente per oltrepassare la superfice.
Lo scopo di questo esperimento è dimostrare che se è presente una barriera tra il soluto ed il solvente, il solvente applicherà una pressione alla barriera per poter passare ed andare a sciogliere il soluto.
In condizioni ideali e trascurando gli urti tra le particelle, la pressione osmotica si india con π può calcolare tramite la legge dei gas perfetti PV = nRT, e quindi
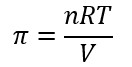
in cui P è la pressione osmotica, n è il numero di moli di solvente, R è la costante dei gas perfetti e V è il volume.
Nell’osmosi inversa invece si applica una pressione sul soluto andare verso il solvente.