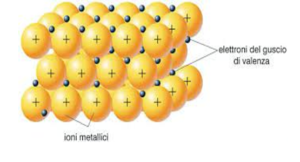
L’ultimo tipo di legame chimico è il legame metallico, in questo tipo di legame gli atomi sono disposti in una struttura cristallina in cui gli elettroni più esterni sono liberi di orbitare attorno a più atomi.
Il legame metallico è responsabile delle seguenti proprietà:
- Alta conducibilità elettrica, causata dal fatto che la banda di valenza (orbitale di valenza) è vuoto o con solo un elettrone, questo significa che basta poca energia per poter togliere elettroni all'atomo.
I metalli si possono distinguere in conduttori (banda di valenza vuota) e semiconduttori (banda di valenza con solo un elettrone su due). I semiconduttori, a differenza dei conduttori, hanno bisogno di più energia per poter cedere un elettrone e la loro conducibilità elettrica si può aumentare tramite il drogaggio, in cui un atomo esterno toglie o dona elettroni.
- Alta conducibilità elettrica data dall’alto movimento degli elettroni che conducono molto più velocemente il calore.
- Sono malleabili perché, a differenza degli altri tipi di legame, hanno i protoni tutti dalla stessa parte e quindi possono essere divisi o deformati facilmente.
- Sono duttili per lo stesso motivo per cui sono malleabili.
- Sono lucidi (riflettono la luce molto meglio degli altri tipi di legame) perché l’alto movimento degli elettroni permette una riflessione migliore della luce.
In basso viene riportata l’immagine di un legame metallico.